酵母双杂交建库-凯发k8网页登录
酵母双杂交建库实验是研究蛋白质相互作用中的一个很重要的实验,首先我们要根据蛋白质的定位,选择不同的建库方式。如果蛋白质定位在细胞核上,是基于gal4酵母单双杂的系统,使用载体pgadt7进行酵母建库;如果蛋白质是定位在细胞膜上,则是基于分离的泛素(split-ubiquitin)介导的膜蛋白酵母双杂交系统,使用ppr3-n载体进行酵母文库的构建。所以大家一定要学会“对症下药”,才能保证实验顺利进行。
既然选好了方向,那我们就要开始正式建库啦。有的小伙伴会经常遇到建库失败的问题,别担心,小金不仅给大家提供了超级好用的酵母建库试剂盒,还给你们总结了实验过程中需要注意的关键细节,大家赶紧进来抄作业吧!
一、酵母建库实验流程图
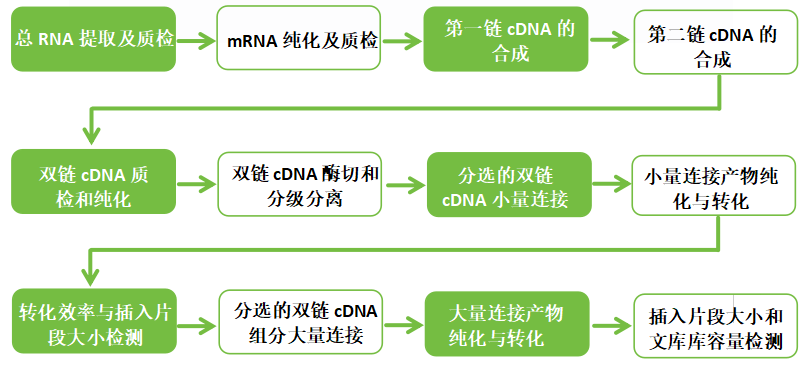
二、酵母建库实验关键点
1、rna提取与质量检测(源头把控)
总rna起始材料的完整性和纯度是高质量 cdna 合成的重要元素,一份高纯度的rna是实验成功的关键,我们可以根据自己的实验材料选择合适的方法提取rna,确保rna电泳图中无降解或污染。rna电泳图如下:
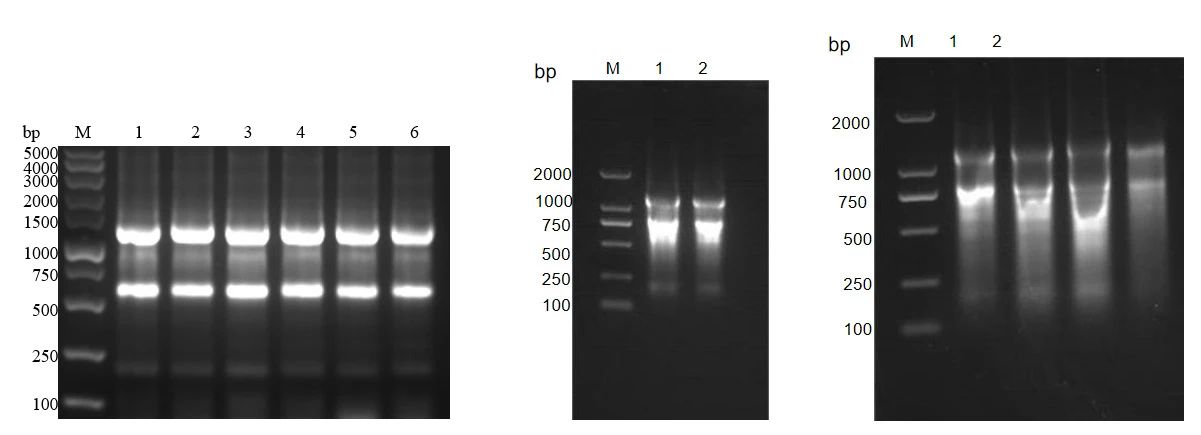
总rna跑胶示例图
左图总rna样品是合格的,中间和右图总rna样品不合格
2、mrna纯化及质检
建议使⽤经过纯化的mrna作为起始材料来进⾏单双链合成,因为纯化的mrna可以排除rrna和trna对下游pcr扩增产⽣的⾮特异性⼲扰,增强⽂库的有效扩增。使用mrna purification kit将mrna从100μg~500μg完整度良好的总rna中进⾏分离纯化。
3、第⼀链cdna的合成
在配备溶液体系的时候,需要保证rna的用量,计算方法:x=总rna加1μg,浓度至少为0.1μg/μl。mrna至少加0.3μg以上,浓度至少为0.1μg/μl),在合成单链cdna后,需保存在-20℃,建议三个月内使用,过期需要重新合成。
|
总rna/mrna样品 |
xμl |
|
cdsⅲ引物(10μm) |
1μl |
|
dntp mix(10mm) |
1μl |
|
无菌h2o |
11-x μl |
|
总体积 |
13μl |
4、第二链 cdna 的合成
这步实验中,可以先扩增50 μl体系,合成的双链cdna进行琼脂糖凝胶电泳检测,确认合格后,再将剩下的一链cdna全部合成二链cdna 。
5、双链cdna质检和纯化
使用pcr-pure kit纯化合成的双链cdna,纯化前一定要检查pw buffer试剂中是否加入无水乙醇,若忘记加入,有可能会导致实验失败。双链的合成实验尽量要在一天之内完成,放置时间太久,可能会影响实验效果。
6、双链cdna酶切和分级分离
酶切过程中要注意,将配备好的酶切体系用移液器轻轻抽打混匀,并且短暂离心确保溶液集中在管底。双链cdna只需要用sfi i酶进行单酶切,通常是1μl切2μgdna,做一次建库需要切10μg的纯化后的双链cdna,有剩下的可以先保存。
分离过程中将离心柱反转几次,去除离心柱中的气泡,同时要控制缓冲液通过离心柱中的流速,如果流速太慢或一滴的体积太小,则需重新重悬基质并重复滴注程序直至达到正常参数。
7、分选的双链 cdna小量连接
连接体系如下,注意cdna和线性化载体按照3:1的比例添加,连接时间大约是16小时左右(时间不宜过短)。
|
双链cdna |
两者摩尔比建议3:1 |
|
pgadt7-sg1,2,3线性化载体(核体系)或ppr3-ns 1,2,3线性化载体(膜体系) |
|
|
10 ×t4 dna ligase buffer |
1μl |
|
t4 dna ligase |
1μl |
|
去离子水 |
补足至10μl |
8、小量连接产物纯化与转化
小量连接转化时,连接产物3μl 97μl dh10b感受态,且小量连接转化只需要鉴定片段长度,所以可以直接涂含有amp抗生素的小平板,每个涂50-80μl左右。
9、转化效率和插入片段大小检测
我们可以从每个组份扩10个菌,跑一下琼脂糖凝胶电泳,判断一下片段长度是否符合要求,确认合格后方可进行下一步实验。
10、分选的双链cdna组分大量连接
大量连接一定要用新鲜的dh10b感受态。而且涂板时尽量不要离心,正着培养,避免大肠菌最后扒在板子上刮不下来,1ml 涂1个大平板(玻璃平板倒厚一些会比较容易收库,塑料平板比较薄很容易收不下来)。
11、大量连接产物纯化与转化
连接产物涂板37℃温箱过夜后,需要根据每个平板的克隆数,铺板体积以及稀释因子来计算文库滴度。在获得原始文库菌液时,需要加入等体积的灭菌的50%甘油,保存于﹣80℃冰箱。用如下方法统计文库滴度,克隆数 = cfu/ml 铺板体积 (ml) ×稀释因子(注意 : 由于移液器的误差,2~5 倍的滴度差异是正常的)。
• 每板克隆数 = 100
• 铺板体积 = 0.1 ml
• 稀释因子 = 10-4
则文库滴度为:
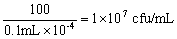
12、插入片段大小和文库容量检测
挑单克隆进行菌落 pcr,抽样检测文库基因插入片段大小,大量文库鉴定一般扩20个左右,可以选10个送去测序,核对种属是否正确。
三、酵母文库检测结果展示
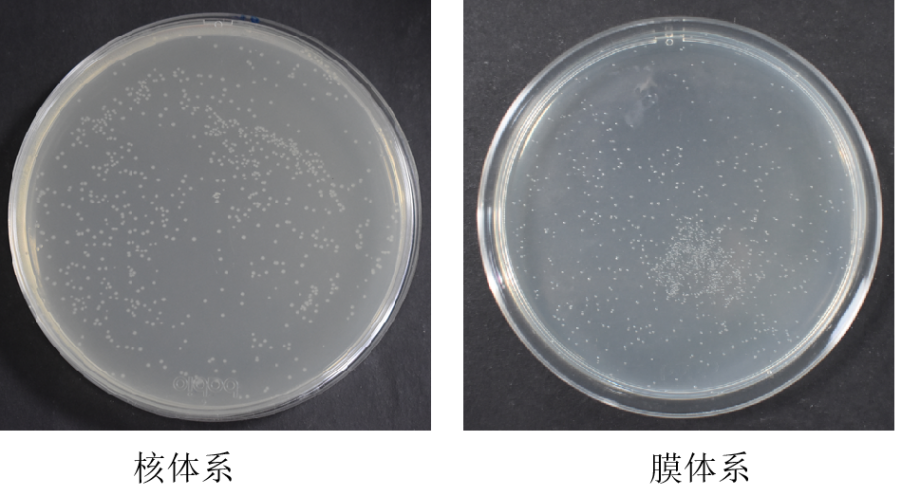
1、试剂盒构建的酵母文库库容量检测结果
2、菌落pcr鉴定结果
核酵母杂交文库构建:文库插入片段pcr鉴定70%在750bp以上,文库的阳性率>90%
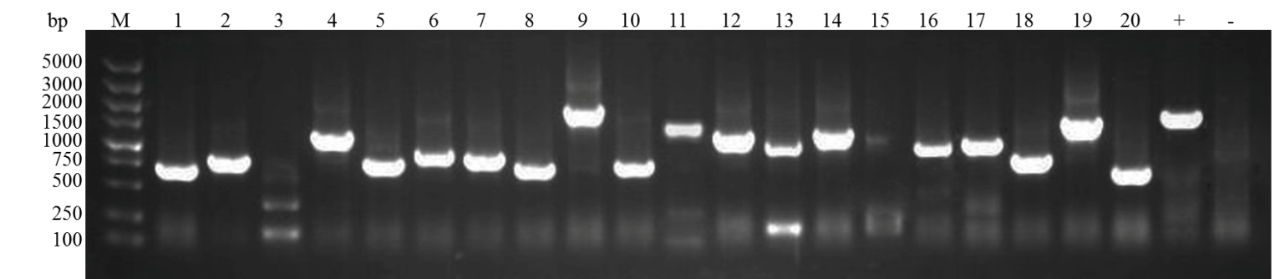
核体系:+:以pgadt7-t为模板
-:以水为模板
膜酵母杂交文库构建:文库插入片段pcr鉴定80%在750bp以上,文库的阳性率>90%
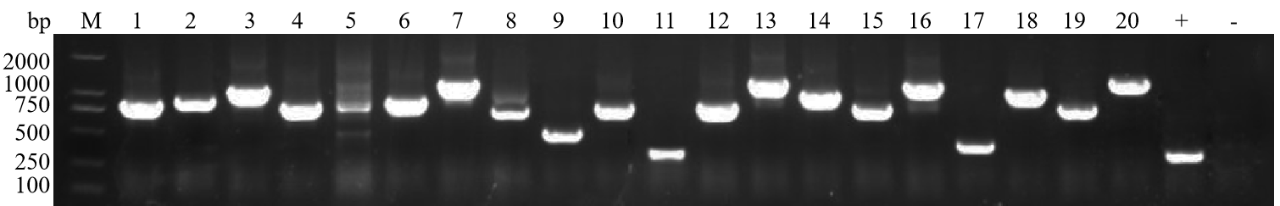
膜体系:+:以ppr3-n为模板
-:以水为模板
四、常见问题与解答
q1、双链cdna跑胶条带小于预期大小
使用的总rna或者mrna存在降解、样品不纯、浓度太低等问题。可以通过以下方法解决:
1、通过琼脂糖凝胶检测总rna和mrna的质量,确保质量和纯度均没有问题(如果rna质量很好,但浓度太低,则使用更多的rna来进行双链的合成;如果rna质量不行,则需要重新提取rna);
2、对rna的稳定性进行检测,如果rna容易降解,检查所用的离⼼管、tip头等是否有rnase的污染,并换⼀种方法重新提取总rna;
3、为了更容易地确定是否是rna的问题,请使用对照rna进行平行反应。
q2、双链cdna产物中存在较多<0.1kb的条带?
可能是pcr的循环数太多了,重新使⽤第⼀链产物进⾏第⼆链的合成pcr时减少3~4个循环数。
q3、如何检测文库质量,文库容量低应该怎么解决?
对于我们提供的大肠杆菌文库甘油菌,可以进行梯度稀释后铺板培养,第二天计算库容量,同时挑取单克隆进行pcr扩增,以判断插入片段长度和空载率。如果检测出文库容量低,有可能是连接效率低,可以通过以下两种方式解决问题:
1、检查分级分离后双链cdna的浓度,双链cdna的浓度应该在100~200 ng/μl的浓度范围内。
2、按照试剂盒说明书中的连接体系,连接体系中线性化载体和双链产物的配⽐不合适,或者连接体系中这两者所加⼊的量太多均会影响连接效率。
q4、dna浓度不足,提取的dna浓度太低,无法满足文库构建的要求。
可以尝试使用其他dna提取方法来提高dna浓度,如酚/氯仿法或商业dna提取试剂盒。此外,可以使用pcr进行dna预增强,以增加可用dna的量。
q5、⽂库插⼊⽚段太⼩?
如果超过50%的克隆具有较小的插入⽚段(即<0.4kb),则双链cdna分级分离不成功。
1、重新合成双链cdna、纯化后酶切双链cdna进行分级分离;
2、严格执行分级分离的实验步骤,例如,在洗涤和洗脱步骤中使用过多或过少的柱缓冲液,或省略⼀个步骤,则柱的分级分离功能将减弱;
3、不要让柱中的基质在洗涤等步骤中变干,干燥的基体可以从柱壳体的内壁收缩
离开。然后,双链cdna混合物可以沿着柱的侧面向下流动,使小污染物过快地进入基质主体,并在早期的级分中洗脱;
4、柱应在室温下储存和使用。如果在4℃下冷却,然后加热到室温使用,可能会形成气泡,从而干扰柱的正常工作;
5、双链cdna混合物在柱表面上的极端不均匀沉积会导致双链cdna与低分子量污染物的低效分离。
最新动态
-
12.03
【干货】全方位解析gst pull-down实验
-
12.03
【干货】一分钟解锁基因调控的秘密 — 转录因子与靶基因预测
-
11.15
【干货】手把手教你做酵母双杂交点对点验证
-
11.14
酵母双杂交点对点验证怎么做?及常见问题回答
-
11.13
酵母双杂交建库-试剂盒操作流程解析及常见问题解答
-
10.17
一文了解 | 酵母双杂交建库原理及流程
-
10.14
盘一盘 诺奖明星-micro rna的前世今生
-
09.30
干货图文| 双荧光素酶报告基因结果解读
-
09.23
中药的现代诠释:外泌体如何革新传统医学?
-
09.10
【客户文献分享】sglt2 抑制剂达格列净可改善高尿酸血症性肾病的肾脏纤维化

- 扫码登入
- 账户密码登入
- 短信验证登入
须知
首次微信扫码用户步骤:
1.微信扫码。
2.本页面完善手机验证。
-

 扫码领资料
扫码领资料扫码领资料

电话:027-87960366
-

 文献奖励申请
文献奖励申请