客户文献分享,if>11|shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章-凯发k8网页登录
研究结果
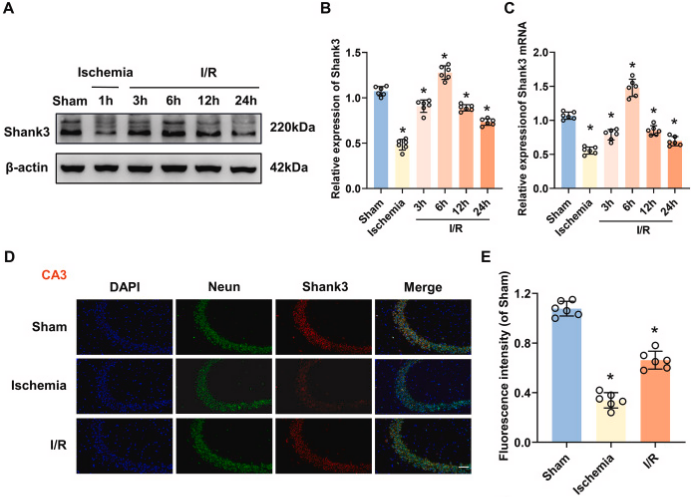
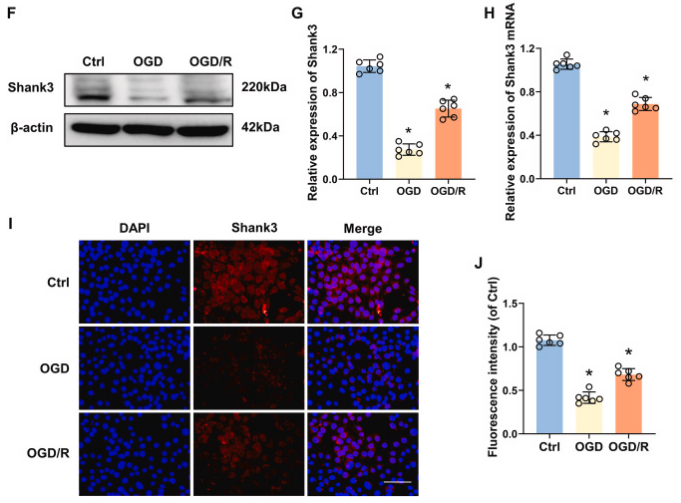
图1. shank3在脑缺血再灌注损伤中的时空表达
a:小鼠海马体shank3蛋白水平在i/r过程中的变化。b:shank3的相对表达量随i/r时间而改变。c:shank3的mrna水平在i/r后发生变化。d:shank3在海马体的定位和表达。e:shank3的染色强度在i/r后发生变化。f:ht22细胞中shank3蛋白水平在ogd和再灌注后的变化。g:shank3的相对表达量在ogd/r处理后发生变化。h:shank3的mrna水平在ogd/r处理后发生变化。i:shank3在ht22细胞的定位和表达。j:shank3的染色强度在ogd/r处理后发生变化。
02、神经元特异性shank3敲除通过促进神经元凋亡加重i/r后的脑损伤
为了深入探究shank3在i/r诱导的神经元损伤中的作用,研究者利用cre-loxp重组技术构建了神经元特异性的shank3敲除小鼠(shank3cko),并验证了敲除效率。尽管shank3cko小鼠表现出部分神经功能缺损,但sham手术影响有限。与对照组相比,shank3cko小鼠在i/r后表现出更严重的神经功能缺损、脑水肿和更高的梗死体积比。western blot和免疫荧光实验结果显示,shank3敲除后,抗凋亡标记物bcl-2/bax比值降低,而凋亡标记物cleaved-caspase3增加。shank3敲除增加了i/r后海马体中tunel阳性细胞的数量。这些结果表明,神经元中shank3的敲除加重了i/r后的脑损伤,并通过促进神经元凋亡导致神经功能恶化。
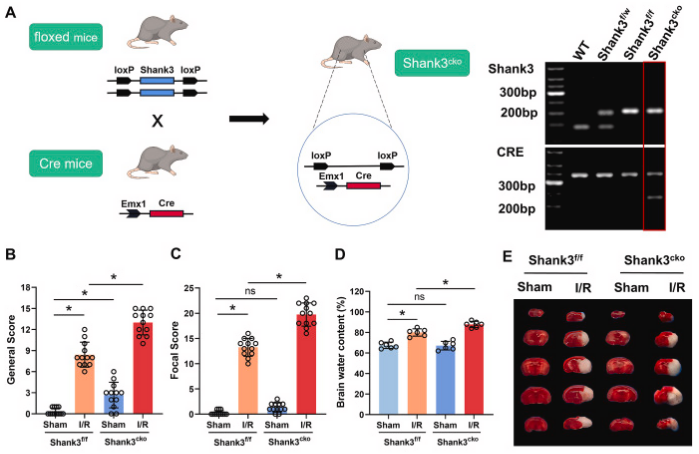
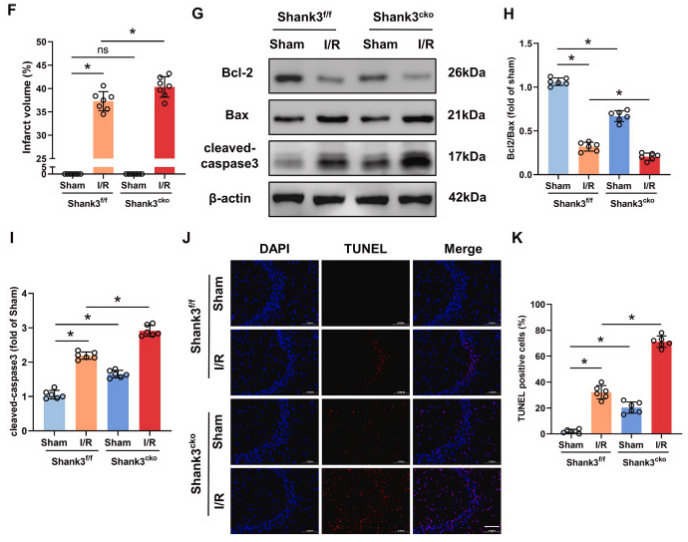
图2. shank3敲除加剧缺血性脑损伤
a:构建shank3的条件性敲除小鼠。b, c:i/r后,shank3敲除小鼠的clark评分显著高于对照组,显示总体和局灶性神经功能缺损。d:脑水肿程度在shank3敲除小鼠中加重。e, f:ttc染色显示shank3敲除小鼠的大脑梗死区域更大。g-i:western blot分析显示shank3敲除后,凋亡标记物增加,抗凋亡标记物减少。j:海马体的共聚焦图像显示在shank3敲除小鼠中更多的tunel阳性细胞(凋亡细胞)。k:tunel阳性细胞数量在shank3敲除小鼠中显著增加。
03、shank3的缺失加剧体内i/r后的氧化应激和炎症
本研究探讨了shank3对氧化应激和炎症的影响,考虑到氧化应激和炎症在i/r诱导的神经元凋亡中的作用。与sham组相比,shank3f/f小鼠大脑中ros和丙二醛(mda)等脂质过氧化产物的水平在i/r后显著增加,而shank3敲除则进一步加剧了这一现象。另一方面,抗氧化剂如gsh-px、gsh、cat和sod的水平在shank3敲除后显著降低。此外,条件性敲除shank3后,促炎细胞因子tnf、il-1β和il-6也显著增加。血清中细胞因子水平的测量显示,shank3敲除与组织中的变化趋势相似。综上所述,敲除shank3加剧了i/r后体内海马体神经元的氧化应激和炎症。
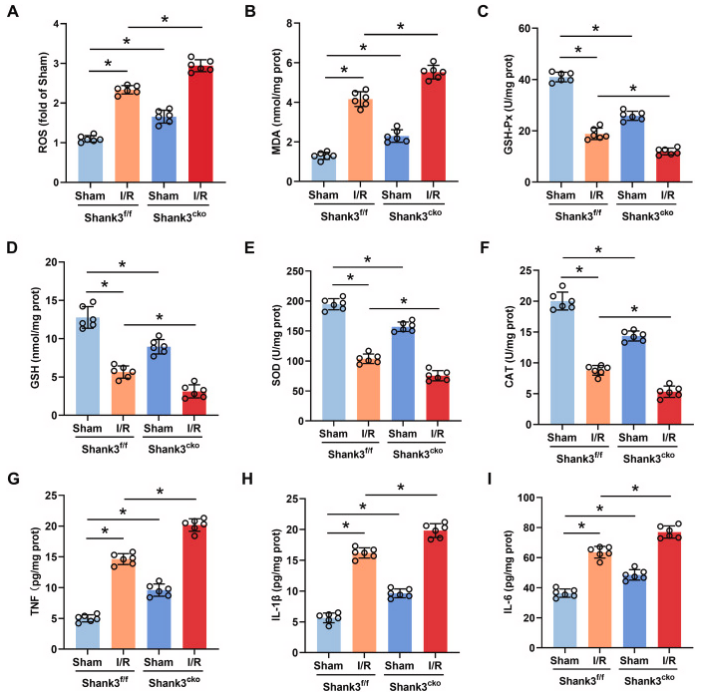
图3. shank3的缺失加重i/r后的氧化应激和炎症
a-i:收集i/r后的海马体组织并匀浆,以测定ros、mda、gsh-px、gsh、sod、cat、tnf、il-1β和il-6的水平。
04、shank3在体外抑制ogd/r后的细胞凋亡、ros产生和炎症
为了阐明shank3对缺血再灌注诱导的细胞损伤的保护作用,在ht22细胞中,通过shrna敲低和慢病毒过表达shank3,然后进行ogd/r处理。与体内实验结果一致,shank3的缺乏增加了凋亡蛋白cleaved-caspase3,降低了bcl-2/bax比率和细胞活力,通过tunel染色也观察到细胞凋亡的增加。此外,敲低shank3显著增加了ros和mda,并降低了抗氧化剂gsh-px、gsh和sod的产生。ogd/r处理后,ht22细胞中tnf、il-1β和il-6等促炎细胞因子的表达增加,由于shank3的缺乏,其表达进一步显著增加。这些由ogd/r和shank3敲低引起的有害效应部分可以通过shank3过表达得到逆转。总的来说,这些结果表明shank3对ogd/r诱导的氧化应激和炎症具有保护作用。
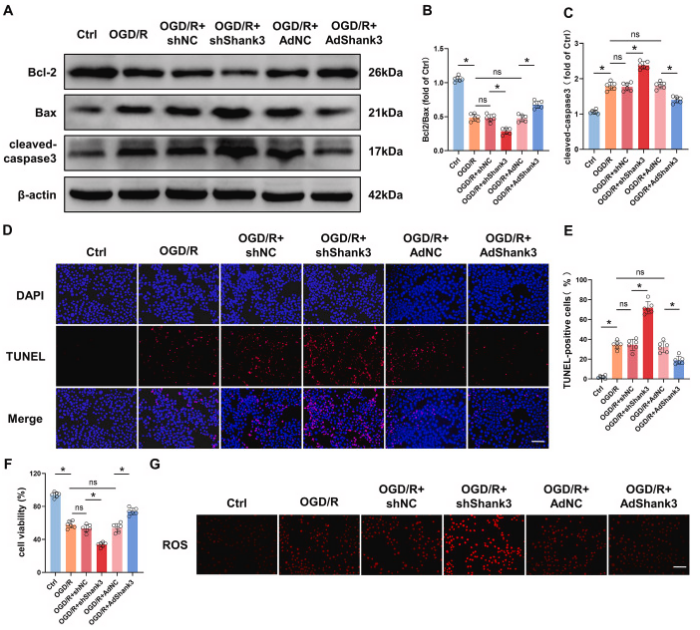
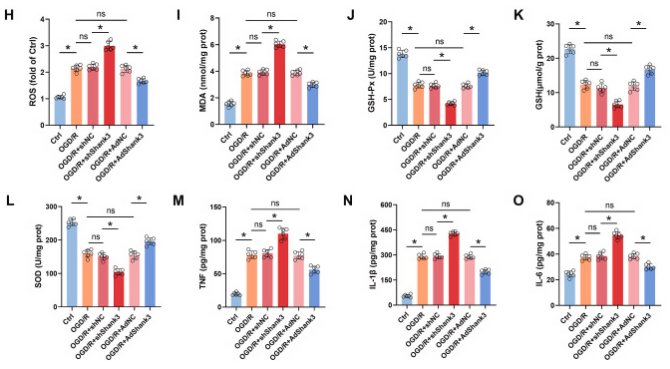
图4. 敲低shank3对ogd/r后ht22细胞中细胞毒性和凋亡的影响
a-c: shank3对bcl-2/bax和cleaved-caspase3的影响。d和e: tunel染色显示凋亡细胞的数量。f: shank3提高ht22细胞的存活率。g和h: shank3降低ros的产生。通过荧光染色观察并量化ros水平,显示shank3能抑制i/r诱导的氧化应激。i-o: shank3对氧化应激和炎症反应的调节。结果显示shank3降低mda(氧化应激标志物)、提高抗氧化酶(如gsh-px、gsh和sod)的表达,并降低炎症因子(如tnf、il-1β和il-6)的表达。
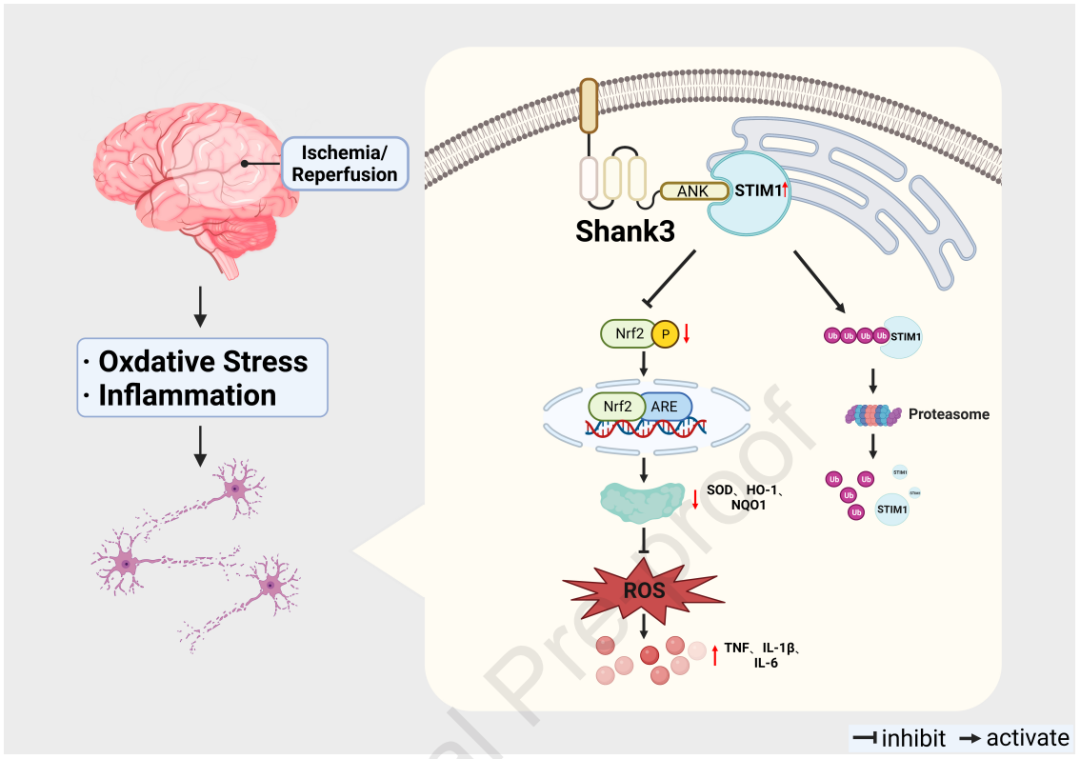
05、shank3与神经元中的stim1直接相互作用
通过对shank3cko和shank3f/f小鼠海马体进行rna-seq分析,揭示了shank3对下游信号传导的影响。go分析显示,与钙离子结合相关的基因表达得到富集。gsea表明,负调控细胞质钙离子浓度的基因集发生了显著变化。我们之前的研究发现stim1的表达增加与神经氧化损伤和细胞凋亡相关,而抑制stim1缓解了钙超载介导的神经损伤。通过分子对接实验,确定了shank3的ank结构域与stim1的soar结构域之间的直接相互作用。免疫荧光实验证明shank3和stim1主要共定位在海马体神经元的细胞质和细胞膜上。免疫共沉淀和gst pull-down实验证实了它们之间的蛋白质相互作用,敲除ank结构域预测的结合位点导致相互作用减弱。shank3过表达降低stim1水平,而shank3敲除增加stim1表达,表明shank3对stim1的表达具有负调控作用。此外,shank3通过泛素-蛋白酶体途径降解stim1。这些结果表明,shank3通过调节stim1稳定性,发挥对i/r后神经氧化应激的保护作用,减少钙离子内流。
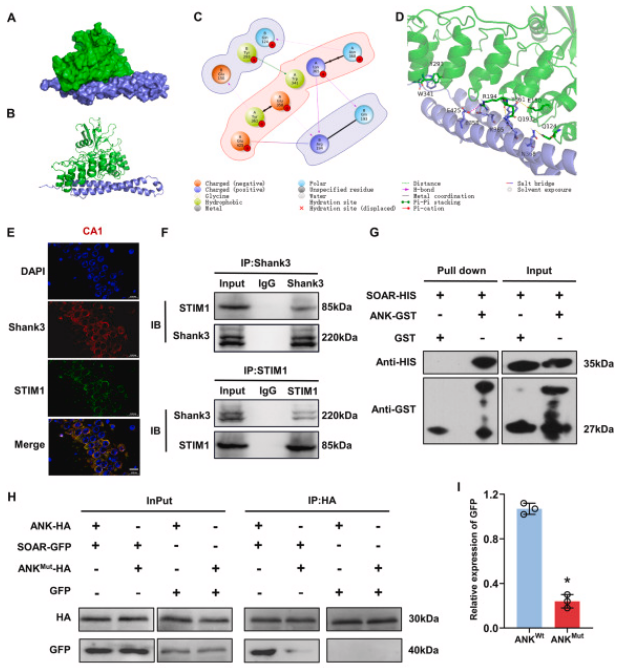
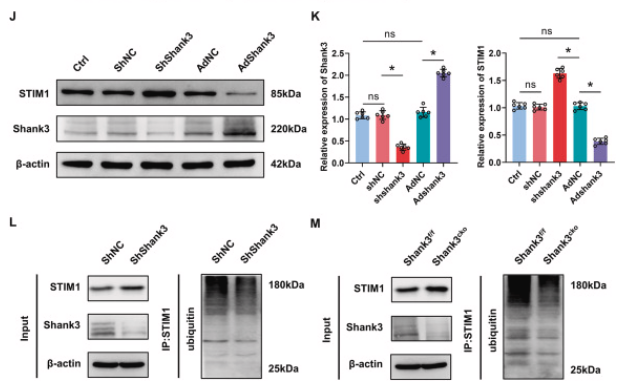
图5. shank3对stim1的调节作用
a、b: shank3的ank结构域与stim1的soar结构域的结合概览。c、d: shank3与stim1结合模式的二维和三维预测分析。e: shank3(绿)和stim1(红)在海马体的荧光染色。f: 通过co-ip实验证明了shank3与stim1之间的蛋白质相互作用。g: gst pull-down实验显示shank3直接与stim1结合。h、i: shank3突变体显著减弱了shank3与stim1之间的蛋白质相互作用。j、k: ht22细胞中shank3和stim1的蛋白水平。l、m: shank3敲低后stim1的泛素化水平变化。
文中的gst pull-down检测由金开瑞合作完成
06、shank3通过下调stim1表达缓解了ogd/r诱导的神经细胞损伤
作者进一步探究了shank3对ogd/r诱导的神经损伤的保护作用是否依赖于stim1。降低stim1表达部分逆转了shank3敲除后ogd/r引起的bcl-2/bax比值下降和cleaved-caspase3表达上调。tunel染色和cck-8实验证明,在stim1和shank3双敲除组中,相比于shank3敲除组,细胞凋亡减少,存活率增加。这些结果表明,shank3通过下调stim1在体外减轻了ogd/r诱导的细胞损伤。
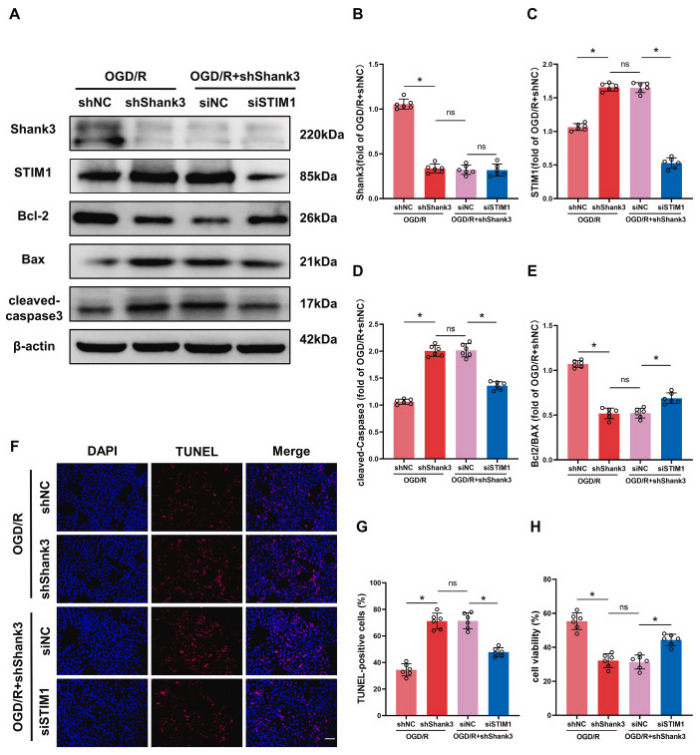
图6. stim1的下调减轻了shank3敲低后ogd/r诱导的细胞损伤
a-e: 在ogd/r后通过沉默stim1影响shank3敲除细胞中shank3、stim1、bcl-2/bax和cleaved-caspase3表达水平的变化。f、g: stim1沉默对ogd/r后细胞凋亡的影响。h: stim1沉默对细胞活力的影响。
07、shank3/stim1相互作用通过nrf2磷酸化和核转位在ogd/r后发挥抗氧化应激作用
研究发现shank3与stim1的相互作用通过nrf2途径对氧化应激和炎症反应产生保护作用。与shnc组相比,敲低shank3增强了ht22细胞在ogd/r后的钙离子流入,而这一现象在stim1沉默后得到显著逆转。钙离子流入增加导致calcineurin表达增加和nrf2去磷酸化。nrf2磷酸化减少抑制了nrf2的核转位,从而减少了下游靶基因如nqo-1和ho-1的表达。然而,stim1沉默逆转了shank3缺陷对各种氧化剂/抗氧化分子的调节作用,包括ros、mda、sod、gsh-px、gsh和sod,以及促炎细胞因子tnf、il-1β和il-6的升高。这些结果表明,shank3/stim1相互作用对ogd/r诱导的氧化应激和炎症活动的保护作用依赖于nrf2的磷酸化和核转位。
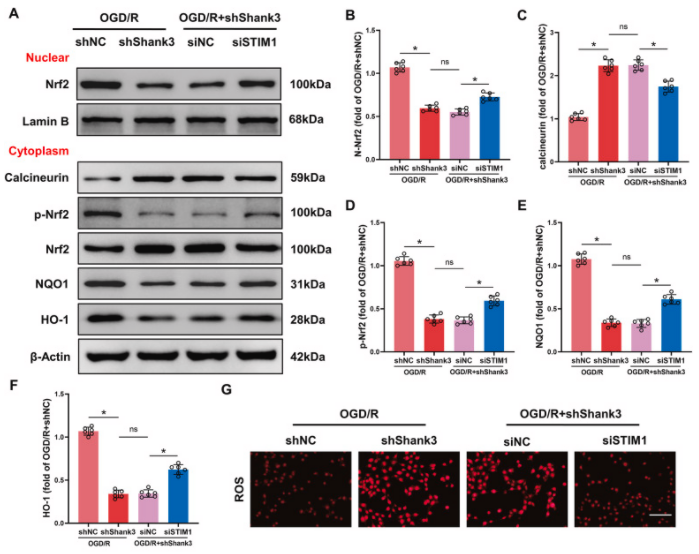

图7. shank3/stim1/nrf2信号通路参与了ogd/r后nrf2核转位和抗氧化应激活性
a-f:在经过ogd/r处理的细胞中通过western blot分析nrf2、calcineurin、p-nrf2、nqo1和ho-1的蛋白水平。g、h:ros水平的荧光染色图像和定量分析。i-l:对包括mda、gsh-px、gsh和sod在内的抗氧化系统的分析。m-o:敲低stim1对tnf、il-1β和il-6的影响。
08、敲低stim1保护shank3cko小鼠免受i/r诱导的脑损伤
为了研究shank3/stim1相互作用在脑缺血再灌注损伤中的作用,研究者对shank3cko小鼠进行aav9-stim1-sgrna或空载体病毒的注射,并进行tmcao/r。stim1沉默显著减轻了shank3cko小鼠i/r后的脑损伤,包括梗死体积和脑水肿的减少。stim1的下调逆转了shank3缺失引起的细胞凋亡,提高了bcl-2/bax比值,降低了cleaved-caspase3水平和tunel阳性细胞数。同时,stim1缺陷小鼠的ros、mda和炎症细胞因子水平下降,而抗氧化酶gsh-px和sod增加。总之,shank3与stim1的相互作用在i/r后对抗氧化应激和炎症反应中具有保护作用。
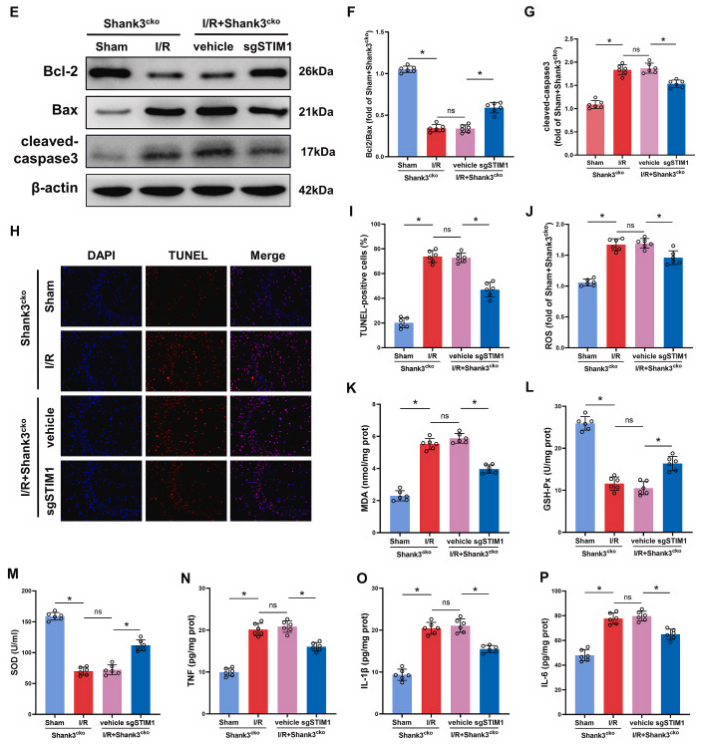
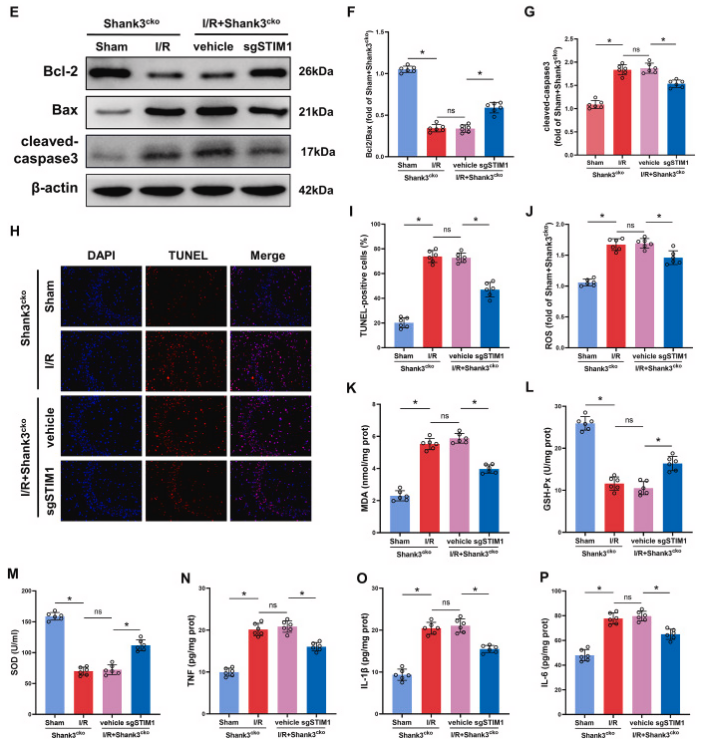
图8. 敲低stim1缓解shank3缺乏引起的缺血再灌注脑损伤
a、b:缺血再灌注后,shank3缺乏的小鼠表现出明显的脑损伤,而敲低stim1显著缓解了这种损伤。c、d:与对照组相比,shank3缺乏的小鼠在缺血再灌注后梗死体积显著增加,而敲低stim1减小了梗死体积。e-g:敲低stim1增加了bcl-2/bax的比率,降低了cleaved-caspase3的水平,从而抑制了细胞凋亡。h、i:敲低stim1显著减少了缺血再灌注后海马体的tunel阳性细胞数量。j-p:敲低stim1降低了氧化应激和炎症指标的水平,具有抗炎和抗氧化作用。
总结
总之,本研究确定了shank3在i/r诱导的神经元氧化应激和炎症中的作用,并揭示了shank3/stim1/nrf2通路在其中发挥作用的机制,从而为i/r提供了一种有前景的治疗策略。
参考文献:https://doi.org/10.1016/j.redox.2023.102983
最新动态
-
12.03
【干货】全方位解析gst pull-down实验
-
12.03
【干货】一分钟解锁基因调控的秘密 — 转录因子与靶基因预测
-
11.15
【干货】手把手教你做酵母双杂交点对点验证
-
11.14
酵母双杂交点对点验证怎么做?及常见问题回答
-
11.13
酵母双杂交建库-试剂盒操作流程解析及常见问题解答
-
10.17
一文了解 | 酵母双杂交建库原理及流程
-
10.14
盘一盘 诺奖明星-micro rna的前世今生
-
09.30
干货图文| 双荧光素酶报告基因结果解读
-
09.23
中药的现代诠释:外泌体如何革新传统医学?
-
09.10
【客户文献分享】sglt2 抑制剂达格列净可改善高尿酸血症性肾病的肾脏纤维化

- 扫码登入
- 账户密码登入
- 短信验证登入
须知
首次微信扫码用户步骤:
1.微信扫码。
2.本页面完善手机验证。
-

 扫码领资料
扫码领资料扫码领资料

电话:027-87960366
-

 文献奖励申请
文献奖励申请
