bifc实验|双分子荧光互补技术|蛋白质互作|载体 -凯发k8网页登录
- 蛋白间相互作用
- 高特异性
- 高灵敏度
- 适用于多种生物体系
服务特色
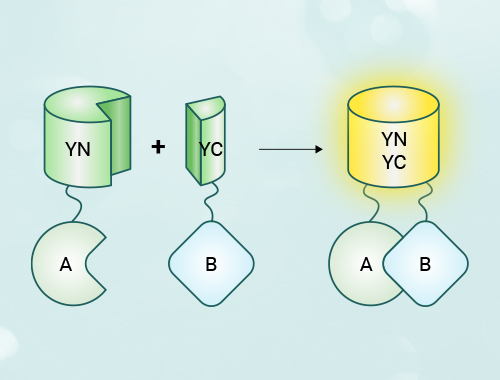
双分子荧光互补(bimolecular fluorescent complimentary, bifc)技术是指通过具有相互作用亲和力的两个蛋白质,将分别与其相连的荧光蛋白片段拉近,组装成完整的荧光蛋白,从而表征蛋白质相互作用的发生及其空间位置。
服务介绍
双分子荧光互补(bimolecular fluorescent complimentary,bifc)技术基于蛋白质片段互补的原理,用于研究蛋白质间的相互作用。其原理是将荧光蛋白(如绿色荧光蛋白gfp、黄色荧光蛋白yfp等)切割为两个互补但各自不发光的片段(如n端和c端片段),分别与待检测的蛋白质a和b融合表达。当蛋白质a与蛋白质b在细胞内发生相互作用时,荧光蛋白片段靠近并重组为完整的荧光蛋白,从而在显微镜下产生荧光信号,直观地反映了蛋白质间的相互作用。
服务优势
- 活细胞内检测:能够在细胞生理状态下直接观察蛋白质相互作用,保留了时空动态信息。
- 高特异性:只有当目标蛋白相互作用时,荧光信号才会出现,减少了假阳性结果,提高了检测的特异性。
- 检测弱或瞬时相互作用:对低亲和力、短暂相互作用敏感,能够揭示一些传统方法难以检测到的相互作用。
服务流程
客户提供
蛋白序列信息
1、客⼾提供载体/模板:需要提供载体mcs测序报告/模板测序结果,如⽆测序报告则需另外收取测序费⽤,由⾦开瑞代为测序。
2、客⼾提供菌液:菌液量应≥0.5ml,放置⼀年以上的⽢油菌需活化后送样。
3、客⼾提供质粒:质粒量≥5μg。
4、菌液和液态质粒均需冰袋运输。
最终交付
- 剩余质粒;
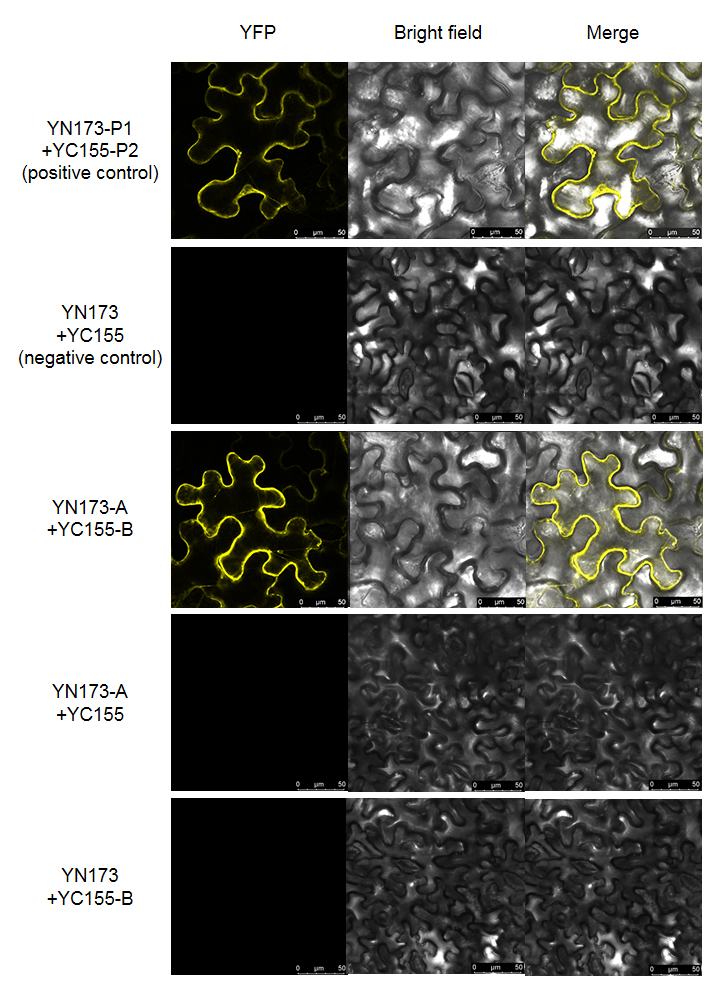
- 阴、阳对照各拍1个视野,2个单分子对照和1个实验组各拍5个视野,每个视野含yfp、bright field、merge 3张图;
- 结题报告以及全部原始数据。
服务说明
1、默认在烟草中进行验证,分组如图所示;
2、判定实验成功的标准:阳性对照有荧光,且阴性对照无荧光;
3、在阴阳对照正常的前提下,若实验组检测到荧光,说明两个蛋白能够互作,反之说明不互作。
案例展示
常见问题与解析 (q&a)
a:为了确保荧光信号的真实性,需要排除假阳性的可能性。假阳性可能是由于荧光蛋白片段的非特异性相互作用或其他非目标蛋白质之间的相互作用引起的。因此,在实验中应设置对照组,如单独表达荧光蛋白片段或目标蛋白的对照组,以排除非特异性相互作用的干扰。此外,还可以结合其他实验方法,如免疫共沉淀(co-ip)、共定位、酵母杂交等,来进一步验证蛋白质相互作用。
a:荧光信号较弱可能是由于荧光蛋白片段与目标蛋白的融合效率不高,或者融合蛋白在细胞内的表达量较低。为了优化荧光信号,可以尝试增强启动子,以提高融合蛋白的表达水平。此外,还可以优化转染条件,确保细胞具有较高的转染效率。在制片过程中,应尽可能清理干净叶片表面的杂质,排除气泡,以减少背景干扰。
a:可能的原因有多种。首先,可能是所研究的蛋白质之间确实不存在相互作用,因此无法形成完整的荧光蛋白。其次,可能是荧光蛋白片段与目标蛋白的融合构建存在问题,导致融合蛋白不能正确表达或折叠。此外,实验条件、细胞状态或转染效率等因素也可能影响荧光信号的检测。针对这种情况,建议重复实验,优化实验条件,并检查融合蛋白的表达情况。
a:bifc技术对实验条件确实有一些特殊要求。首先,温度是影响bifc实验结果的重要因素。由于该系统对温度敏感,较高的温度可能导致荧光蛋白片段不易互补形成完整的荧光蛋白,因此需要在适当的温度下进行实验。其次,细胞的生长状态和转染效率也会影响实验结果,因此需要控制好细胞的培养条件和转染条件。此外,为了避免背景荧光的干扰,实验过程中需要注意操作细节,如保持实验环境的清洁、避免光线的直接照射等。
相关技术服务
| ▶ 酵母单杂交 | ▶ 酵母双杂交 | ▶ emsa | ▶ co-ip |
| ▶ cut&tag | ▶ rna pull-down | ▶ rip-qpcr | ▶ dna pull-down |
| ▶ chip-qpcr | ▶ 双荧光素酶报告系统 | ||
相关资源
1、bifc技术应用
● 蛋白质互作网络研究:揭示复杂信号通路中蛋白质间的直接相互作用。
● 细胞内定位与动态研究:观察蛋白质相互作用在细胞内的空间分布及其随时间的变化。
● 药物筛选与验证:检测候选药物对特定蛋白质相互作用的影响,评估其生物活性。
● 植物科学:研究植物生长发育、逆境响应、信号传递等过程中的关键蛋白质互作。
● 神经科学:揭示神经元间或神经元内部蛋白质的相互作用,如突触形成、神经递质释放、离子通道调控等。
● 癌症研究:研究致癌基因与抑癌基因、癌蛋白与微环境因素的相互作用,揭示癌症发生发展的分子机制,为诊断、预后评估和个性化治疗提供依据。
2、bifc实验流程
● 构建融合蛋白:设计并合成针对目标蛋白a和b的特异性引物,将其分别与荧光蛋白n端和c端片段基因融合,构建相应的表达载体。
● 细胞转染:将含有融合蛋白a-n端和b-c端片段的载体同时或分别转入感兴趣的细胞系,实现融合蛋白的共表达。
● 荧光观察:转染后一段时间(通常24-48小时),使用荧光显微镜或共聚焦显微镜观察细胞,若观察到绿色(或对应荧光蛋白颜色)荧光信号,说明蛋白质a和b发生了相互作用。
3、bifc实验优化与注意事项
● 融合片段选择:选择对荧光蛋白功能影响较小的片段融合位点,确保片段重组后荧光蛋白功能恢复。
● 荧光蛋白选择:考虑荧光蛋白的亮度、稳定性、光谱特性等因素,选择最适合实验条件的荧光蛋白。
● 对照设置:包括阴性对照(表达单个荧光蛋白片段的细胞)和阳性对照(已知存在相互作用的蛋白质对)。
● 转染效率与表达水平监控:确保细胞转染效率足够高,且融合蛋白表达水平适中,避免过表达干扰。
4、几种常见的蛋白互作研究方法的对比分析:
|
方法 |
原理 | 优点 | 缺点 |
|
利用酵母细胞中的转录因子进行互作蛋白的筛选 |
适用于高通量筛选互作蛋白 | 假阳性较高,需进行验证 | |
| 利用抗体与抗原的特异性结合,沉淀互作蛋白 | 可用于研究完整细胞内的蛋白互作 | 不适用于结合力弱或瞬间结合的蛋白 | |
| 利用gst融合蛋白与谷胱甘肽的结合特性,钓取互作蛋白 | 可用于体外验证蛋白互作 | 可能存在非特异性结合 | |
|
双分子荧光互补(bifc) |
利用荧光蛋白片段的互补特性,观察蛋白互作的荧光信号 |
可实时监测蛋白互作的动态过程 | 可能受荧光蛋白片段选择、细胞类型等因素影响 |
|
免疫荧光共定位 |
利用荧光标记的抗体检测蛋白在细胞内的定位 | 可用于研究蛋白在细胞内的分布和互作关系 | 需要进行多重染色和显微观察,操作复杂 |
|
蛋白质芯片 |
将蛋白质固定在芯片上,与待测蛋白进行互作反应 | 可高通量筛选互作蛋白 | 芯片制备复杂,成本较高 |
每种方法都有其独特的优点和局限性,研究者应根据实验目的、细胞类型、蛋白特性等因素选择合适的方法。此外,通常建议采用多种方法进行相互验证,以提高结果的可靠性和准确性。






